 登录 / 注册
登录 / 注册
慧选网编辑部了解到,2021年1月1日起首批9大类69个医疗器械品种实施唯一标识之后,第二批实施医疗器械唯一标识工作也即将启动。《意见稿》指出,在《国家药监局 国家卫生健康委 国家医保局关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告》规定的9大类69个品种的基础上,将其余第三类医疗器械(含体外诊断试剂)纳入第二批实施唯一标识范围。
实施时间:
2022年3月1日起,生产的医疗器械应当具有医疗器械唯一标识。
2022年3月1日起,申请首次注册、延续注册或者注册变更时,注册申请人/注册人应当在注册管理系统中提交其最小销售单元的产品标识。
2022年3月1日起,生产的医疗器械上市销售前,注册人应当按照相关标准或者规范要求将最小销售单元、更高级别包装的产品标识和相关数据上传至医疗器械唯一标识数据库。
相关要求:
医疗器械注册人要落实企业主体责任,鼓励基于唯一标识建立追溯体系,做好产品召回、追踪追溯等相关工作。
医疗器械经营企业要在经营活动中积极应用唯一标识,做好带码入库、出库,实现产品在流通环节可追溯。
医疗机构要在临床使用、结算报销等临床实践中积极应用唯一标识,做好全程带码记录,实现产品在临床环节可追溯。
金蝶云·星空UDI一体化解决方案
基于金蝶云·星空强大的业务平台,让医疗器械企业真正实现一体化的解决方案。
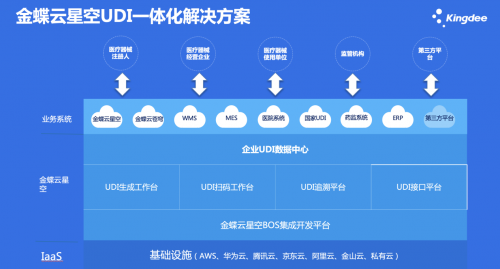
基于UDI在生产环节实现发码赋码及追溯工作
按照UDI试点要求,医疗器械注册人企业需要按照唯一标识系统规则和标准,对其产品创建唯一标识,完成唯一标识数据库数据上传工作,向下游企业或者使用单位提供标识信息,探索建立标识在产品追溯中的应用模式。
实现扫 UDI 码即可对照相关采购记录与到货的医疗器械进行核对;加强对退货的管理,保证退货环节医疗器械的质量和安全,防止混入不合格医疗器械。
文章来源:大京网




